Sesquicentenario de la Tabla Periódica de Mendeleiev
Oscar E. Piro Instituto IFLP (CONICET) y Departamento de Física, FCE, UNLP, CC 67, (1900) La Plata
Resumen La aparentemente insondable complejidad de las propiedades fisicoquímicas de una lista creciente de elementos químicos descubiertos y su virtualmente infinito número de compuestos estimuló a los científicos en la búsqueda de regularidades y patrones de comportamiento de dichos elementos. El resultado fue la Tabla Periódica de los Elementos Químicos, una sucinta organización del conocimiento acumulado durante siglos. Es una notable demostración que los elementos no son una mera colección de entidades al azar sino que exhiben tendencias y se organizan en familias. La Tabla Periódica es una referencia esencial en el entendimiento de la estructura y propiedades de la materia. Aquí hacemos una breve descripción del desarrollo histórico de la Tabla Periódica hasta fines del siglo XIX, uno de los logros más significativos de la ciencia que captura aspectos esenciales de la química y la física. (Trabajo en prensa aceptado para el número 8 de la revista NUCLEOS de la Editorial UNNOBA)
1. La evolución de la Tabla Periódica
Principios guía históricos para construir la Tabla Los elementos se asocian en grupos basados en similaridades en sus propiedades químicas y físicas. Presentan también ciertas conspicuas regularidades numéricas en sus masas atómicas relativas. Por ejemplo, la masa atómica de un miembro de grupo parece coincidir con el promedio de las masas atómicas de los elementos por arriba y debajo de él. Así, por ejemplo, la media de los pesos atómicos del calcio y bario da una buena aproximación al peso atómico del estroncio; el del sodio es cercano al valor medio de los pesos atómicos del litio y potasio; similarmente, azufre y telurio indican al selenio como el elemento del medio.
1.1. Las triadas de J. W. Döbereiner
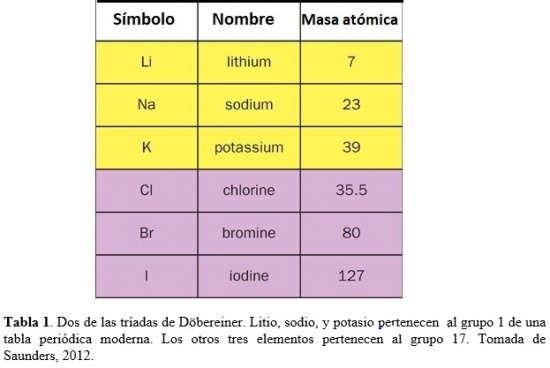
Durante los años 1820’s, Johann Wolfgang Döbereiner (químico Alemán, 1780-1849) notó que ciertos elementos formaban patrones. Por ejemplo, que el litio, sodio, y potasio tenían propiedades parecidas. Todos estos metales son blandos y livianos pero muy reactivos. Si se los lista en orden creciente de masas atómicas relativas, ese orden es también el de reactividad creciente. Cloro, bromo e iodo son no-metales muy reactivos que, en particular, se combinan fácilmente con el sodio dando lugar a cristales blancos de fórmula química NaX. Si se los lista en orden de masas atómicas relativas crecientes, ellos se disponen en orden de reactividad decreciente (Saunders, 2012). Döbereiner llamó a tales familias de tres elementos triadas (ver Tabla 1). Basado en valores para las masas atómicas relativas reportados por Jöns Jacob Berzelius (químico Sueco, 1779-1848), notó que la masa atómica del elemento del medio en cada tríada era el promedio de los otros dos. Las triadas de Döbereiner fueron un primer intento de agrupar los elementos y mostrar que podrían estar relacionados entre sí a través de sus masas atómicas.
Las tríadas de Döbereiner fueron extendidas por otros químicos para incluir más de los tres elementos originales. Por ejemplo, se agregó el flúor encima de la tríada conteniendo cloro, bromo, e iodo. Se propusieron también otras ‘triadas’, tal como una conteniendo oxígeno, azufre, selenio, y teluro. Pero no se disponía de un sistema que conectara todas estas asociaciones. Uno de los problemas consistía en que los valores de muchas masas atómicas relativas eran entonces incorrectos.
1.2. La espiral telúrica de A.-E. de Chancourtois
En 1862, Alexandre-Emile de Chancourtois (geólogo Francés, 1820–1886) construyó una tabla periódica colocando los elementos en orden creciente de masas atómicas. Para ello usó los valores más precisos de la época, particularmente aquellas basada en el trabajo de Stanislao Cannizzaro (químico Italiano, 1826-1910), quien resolvió el problema de las grandes variaciones en masas atómicas calculadas por diferentes químicos. De Chancourtois dibujó su tabla sobre un papel enrollado alrededor de un cilindro, formando una espiral con el teluro a mitad del camino descendente, de allí el origen de su nombre (ver Fig. 1).
En un cilindro de de Chancourtois con 16 unidades de masa perimetrales, las tríadas de Döbereiner aparecen en columnas verticales. También, las propiedades de los elementos sobre la espiral se repiten con cada vuelta alrededor del cilindro. De Chancourtois fue el primero en colocar los elementos conocidos entonces en orden creciente de sus masas atómicas y encontrar un patrón repetitivo. A pesar de algunos méritos, la espiral fue ignorada por los químicos. Algunas de sus partes mostraban tendencias generales pero otras no y era difícil de usar.
1.3. Ley de las octavas de J. Newlands
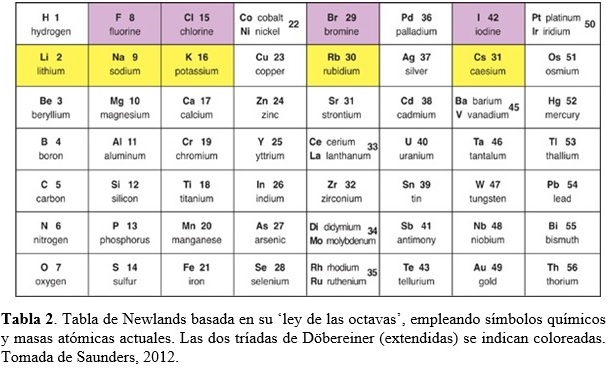
En 1865, John Newlands (químico Ingles, 1837-1898) publica una tabla plana donde arregla los elementos conocidos en orden creciente de sus masas atómicas, tal como lo hiciera de Chancourtois (Tabla 2). “When elements are arranged in increasing order of their atomic mass, the eighth element resembles the first in physical and chemical properties just like the eighth note on a musical scale resembles the first note.” John Newlands
Newlands llamó a su invención “ley de las octavas”. Una octava consistía de un primer elemento, el octavo elemento después del primero, y los seis elementos entre el primero y el octavo. Así, el litio y el sodio se sitúan en los extremos opuestos de una octava. El oxígeno y el azufre en los extremos opuestos de una octava diferente. De esta manera, elementos con propiedades similares aparecían en la misma fila de la tabla (ver Tabla 2). La primera columna de su tabla contenía los elementos del hidrógeno al oxigeno, los mismos siete elementos que en la primera espira de la espiral telúrica de de Chancourtois, y las tríadas de Döbereiner aparecían en sus filas. Desafortunadamente, el arreglo en octavas de Newlands no resultó exitoso y solo funcionaba hasta el calcio. Más allá, la tabla resultaba químicamente inconsistente. Por ejemplo, el hierro estaba en la misma fila que el oxígeno y el azufre. El cobre, un metal muy poco reactive, estaba posicionado entre el potasio y el rubidio, dos metales muy reactivos. Newlands incluyó en su tabla todos los elementos conocidos en su época, pero continuamente se descubrían nuevos elementos para los cuales no tenía cabida en las últimas versiones de su arreglo (Saunders, 2012). Históricamente, la tabla de Newlands puede considerarse un avance porque no solo ordenó los elementos de acuerdo a masas atómicas crecientes, sino que encontró en dicho arreglo algunos patrones repetitivos en las propiedades químicas. A pesar que partes de su tabla eran confusas, la misma fue el primer intento en elaborar una tabla periódica tal como la conocemos actualmente.
1.4. Tabla basada en la valencia química de J. L. Meyer
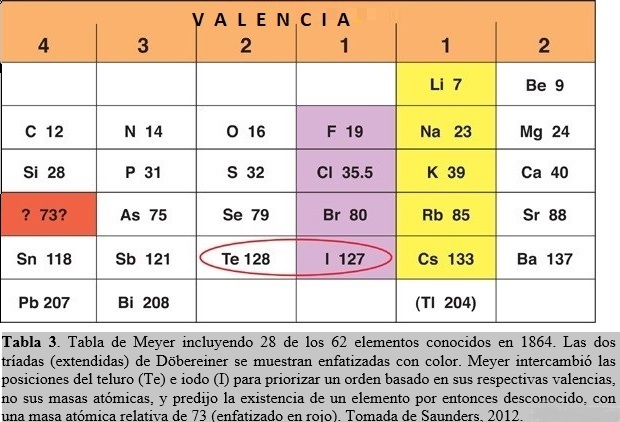
En 1864, Julius Lothar Meyer (químico Alemán, 1830-1895) inventó una tabla donde, como en las de de Chancourtois y de Newlands, los elementos estaban arreglados en orden creciente de masas atómicas. Pero a diferencia con éstos últimos, Meyer arregló los elementos en seis columnas, basado en su capacidad para formar enlaces químicos. Cada elemento en una misma columna presentaba la misma valencia, esto es, sus átomos podían formar el mismo número de enlaces. Estaba tan convencido que esta era la forma correcta de posicionar los elementos en la tabla que hasta intercambió el orden (dictado por las masas atómicas) de dos elementos. El teluro posee una masa atómica relativa mayor que el iodo, por lo que éste último elemento debería anteceder al primero. Pero Meyer permutó sus posiciones en favor de acordar con un orden basado en sus respectivas valencias, no sus masas atómicas (Tabla 3).
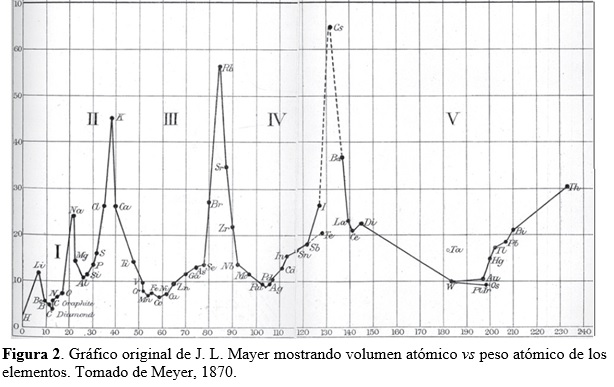
Meyer examinó la diferencia entre las masas atómicas de elementos en columnas adyacentes y pertenecientes a la misma fila de la tabla y notó que, en general, era un número pequeño (alrededor de dos). Para mantener este patrón, tuvo que desplazar un lugar hacia abajo a dos elementos de la columna izquierda de su tabla. Esto implicó la generación de un hueco en la misma que podría corresponder a un elemento aún no descubierto, con una masa atómica estimada en alrededor de 73 (ver Tabla 3). Posiblemente el mayor aporte de Meyer yace en su énfasis sobre propiedades físicas, tales como volúmenes atómicos, densidades y fusibilidades, para dilucidar el comportamiento periódico de los elementos. En particular, publicó un revelador diagrama mostrando la periodicidad exhibida por los volúmenes atómicos de los elementos (Fig. 2). Estos volúmenes pueden calcularse a partir de medidas de densidad (ρ) en el estado condensado (líquido, sólido) de los elementos. En efecto, consideremos un átomo gramo A de un elemento ocupando un volumen V, entonces ρ = A/V. Debido a que existe en A gramos un número de Avogadro NA de átomos, que están empaquetados de manera muy compacta en el condensado, podemos asociar un volumen v por átomo de acuerdo a V = NAv, obteniendo de esta manera para el ‘volumen atómico’ la expresión v = A/NA ρ ó v proporcional a A/ρ.
El hacer predicciones razonables que resulten más tarde verificadas por la experiencia constituye una importante característica del avance de la ciencia. En este aspecto, la tabla de Meyer podría haber sido un reconocido éxito científico a no ser por una seria limitación: sólo contenía 28 de los 62 elementos conocidos entonces. A pesar que trató de ordenar otros 22 elementos en una tabla separada, sus esfuerzos no culminaron con una tabla funcional medianamente completa que facilitara el trabajo de los científicos. En conclusión, la tabla de Meyer constituyó un gran avance debido a que ordenó los elementos de acuerdo a sus masas atómicas relativas y valencias. Tuvo la visión de intercambiar el orden canónico (basado en masas atómicas) de dos elementos (teluro e iodo) para priorizar su esquema de orden basado en valencia y predijo la existencia de un elemento que sería descubierto más tarde (germanio). También mostró que la periodicidad en el comportamiento químico de los elementos tiene su contrapartida en la periodicidad observada de sus respectivas propiedades físicas.
1.5. Tabla de D. I. Mendeleiev
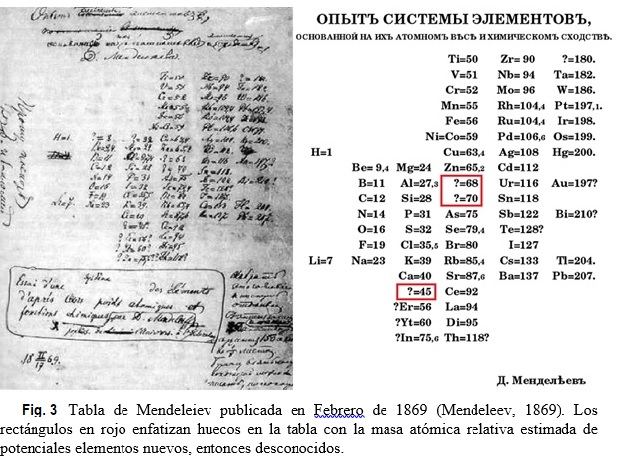
Muy breve biografía: Dimitri Ivanovich Mendeleiev (químico ruso, 1834-1907) era el más joven de catorce hermanos. Su familia no era acaudalada, pero Dimitri era brillante y muy trabajador. En 1855 se graduó en la Universidad Estatal de St. Petersburgo. Mendeleiev asistió a una importante conferencia internacional de química, realizada en 1860 en Karlsruhe, Alemania, donde se encuentra con líderes de la química europea. Más tarde recordaría la presentación de Cannizzaro sobre masas atómicas relativas como particularmente importante en su investigación. En 1865 es nombrado Profesor de la Universidad de St. Petersburgo. Estimulado por su actividad docente como Profesor de química, en 1867 Mendeleiev decide escribir un libro de texto sobre el tema. Durante esta tarea, percibió que algunos elementos químicos poseían propiedades similares y que sería muy útil el diseñar una forma de organizarlos. Mendeleiev elaboró una tarjeta para cada elemento químico conocido. En cada una de ellas, escribió la masa atómica relativa del elemento e información acerca de sus propiedades. Aficionado al juego de cartas, construye una suerte de solitario con las tarjetas y luego trata de organizarlas de todas las maneras posibles, intercambiándolas hasta obtener un arreglo satisfactorio. Este procedimiento le tomó un día, pero había estado pensando sobre el tema en forma discontinua durante años. Mendeleiev publica su primera versión de la tabla periódica en 1869 (ver Fig. 3).
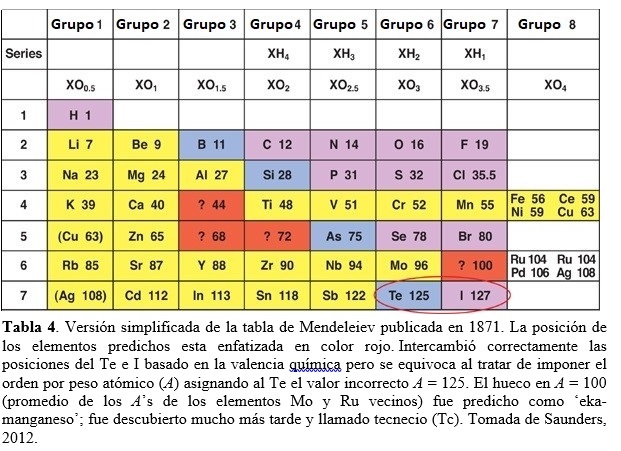
Mendeleiev continúa perfeccionando su tabla, produciendo varias versiones, y publica una explicación detallada de sus ideas en 1871 (Mendeleev, 1871). Su tabla periódica más famosa de ese año estaba arreglada verticalmente, en la misma manera que una tabla moderna (ver Tabla 4). Mendeleiev dispuso los elementos en orden creciente de sus masas atómicas, tal como lo hicieran antes de Chancourtois, Newlands y Meyer. Las filas horizontales fueron llamadas series, similares a los períodos modernos. Los elementos con propiedades similares se disponían según columnas verticales llamadas grupos, como actualmente (Saunders, 2012).
A partir de la Tabla 4, podemos apreciar la notable capacidad predictiva de Mendeleiev. En efecto, dejo en su tabla huecos y predijo que serían llenados por nuevos elementos a ser descubiertos. En parte promediando las propiedades de elementos rodeando tales huecos, profetiza exitosamente en 1871 el descubrimiento de cuatro nuevos elementos: (i) El que llamó ‘eka-boron’, predicho con peso atómico A = 44 (ver Tabla 4: probablemente, Mendeleiev promedió los pesos atómicos de los elementos Ca (A = 40) y Ti (A = 48) adyacentes en la fila), fue descubierto en 1879 por Lars F. Nilson (químico Sueco, 1840-1899) y llamado escandio (valor actual A = 44,96). (ii) ‘Eka-aluminio’, predicho con A = 68, fue descubierto en 1875 por Paul Emile Lecoq Boisbaudran (químico Francés, 1838-1912) y llamado galio (actual A = 69,7). (iii) ‘Eka-silicio’, predicho con A = 72, fue descubierto en 1886 por Clemens Winckler (químico Alemán, 1838-1904) y llamado germanio (actual A = 72,6). Previamente, J. L. Meyer también había predicho un lugar en su tabla de 1862 (publicada en 1864) para un elemento entonces desconocido con A = 73,1. (iv) El cuarto elemento predicho exitosamente por Mendeleiev, el ‘eka-manganeso’ (con A = 100 en Tabla 4), debió esperar 66 años hasta ser descubierto en 1937 (como el primer elemento artificial) por Carlo Perrier (químico y minerólogo Italiano, 1886-1948) y Emilio G. Segré (físico Italiano, 1905-1989) en muestras de molibdeno (Mo) irradiadas con deuterio, provistas por Ernest O. Lawrence (físico Estadounidense, 1901-1958). Se le dio el nombre de tecnecio (Tc). Como Meyer, Mendeleiev privilegió en su tabla las propiedades químicas (como la valencia) frente al por entonces aceptado orden por pesos atómicos, en parte porque pensó que ciertos pesos atómicos habían sido determinados incorrectamente. Así posicionó el teluro (Te) antes de iodo (I), a pesar que el primero posee un peso atómico ligeramente superior al segundo (en su tabla original de Fig. 3: 128 vs 127; actualmente 127,6 vs 126,9). Hoy sabemos que el orden de Mendeleiev para Te e I era correcto dado que el verdadero orden atómico se basa no en el peso atómico sino en el número atómico (Z). En efecto, Te (Z = 52) es seguido en la fila por el I (Z = 53). Otro ejemplo interesante del método de Mendeleiev para posicionar elementos químicos en la tabla, como así también el uso de métodos físicos para este fin, lo constituye el caso del berilio, Be (Scherri, 2007). La cuestión era si debía asignarse al elemento una valencia de 2 (y entonces asociarlo al grupo II que incluye el magnesio) o una valencia de 3 (asociado al grupo III del aluminio). Esta cuestión estaba correlacionada con determinar el peso atómico correcto del berilio. Los métodos químicos para determinar pesos atómicos relativos, como el de Cannizzaro, no eran de fácil aplicación a elementos metálicos dado que requerían compuestos volátiles. Un método físico alternativo para determinar pesos atómicos de sólidos como el berilio empleaba una ley empírica enunciada en 1891 por Pierre-Louis Dulong (físico y químico Francés, 1785-1838) y Alexis-Thérèse Petit (físico Francés, 1791-1820). Esta ley establecía que el calor específico (en cal/grºC) de cualquier elemento sólido multiplicado por su peso atómico (lo que da el calor específico molar) es aproximadamente igual a una constante (alrededor de 6 cal/molºC). De esta manera, es posible determinar el peso atómico de un elemento ajustando el valor del mismo tal que su producto con el calor específico observado satisfaga la ley, esto es:
peso atómico × calor específico = constante = 5.96 cal/molºC
El calor específico del berilio a temperatura normal resultó ser igual a 0,4079. De acuerdo a la ley, esto indicaba un valor de 14,6 para su peso atómico que colocaría el elemento en el mismo grupo que el aluminio trivalente. Además del peso atómico, había otras razones de naturaleza química para esta asociación. Así, parecía convincente que el berilio perteneciera al mismo grupo que el aluminio. A pesar de esta evidencia, Mendeleiev opinaba que el berilio era divalente, usando argumentos tanto puramente químicos como también basados en el sistema periódico. Señaló que el sulfato de berilo presenta una mayor similitud con el sulfato de magnesio que con el sulfato de aluminio y que mientras los elementos análogos al aluminio forman alumbres (formula actual: XAl(SO4)2.12H2O, donde X es un catión monovalente, como potasio, amonio, etc), el berilio no lo hace. El también argumentó que si el peso atómico del berilio fuera alrededor de 14, no habría lugar para él en el sistema periódico. Mendeleiev hizo notar que tal peso atómico colocaría el berilio cerca del nitrógeno, hacia el lado derecho de la tabla, donde debería mostrar un marcado carácter ácido y formar óxidos superiores del tipo Be2O5 y BeO3, lo que no era el caso. En cambio, Mendeleiev argumentó que el peso atómico del berilio podría ser aproximadamente 9, valor que lo posicionaría en la tabla periódica entre el litio (7) y el boro (11), concluyendo también de esta manera que debía pertenecer al grupo II. La cuestión fue finalmente resuelta en 1885 de manera concluyente en favor de Mendeleiev, mediante medidas del calor específico del berilio a altas temperaturas. El calor específico de cualquier elemento en estado sólido crece con la temperatura. Como resultado, el valor constante que aparece en la ley de Dulong y Petit sólo es alcanzado si las medidas se realizan a temperaturas elevadas. Esto se pudo apreciar poco después del descubrimiento de la ley de Dulong y Petit (lo que permitió medidas más precisas de pesos atómicos), y fue racionalizado en el contexto de la mecánica estadística cuántica por Einstein (1906), considerando una sola frecuencia de vibración del sólido. El tratamiento fue perfeccionado más tarde por Debye (1912), quién consideró una distribución más realista de los modos de vibración del sólido. De esta manera se concluye que el valor límite de Dulong-Petit para el calor específico molar del sólido es alcanzado para temperaturas mayores que la llamada ‘temperatura TD de Debye‘, cuando es válido aplicar la ley clásica de equipartición de la energía. Esta temperatura es el nivel térmico (in ºK) asociado con las vibraciones más energéticas del sólido y está definida por kBTD = hυmax, donde kB es la constante de Boltzman, h la constante de Plank y υmax es la máxima frecuencia de vibración de red cristalina. Como en un sistema masa-resorte simple, esta frecuencia tiende a ser alta para elementos de pequeña masa atómica y enlaces metálicos fuertes, como es el caso del elemento liviano berilio que funde a 1560ºK. En efecto, la temperatura de Debye de este elemento es TD = 1440ºK. Medidas de calores específicos del berilio a altas temperaturas indicaron un peso atómico próximo a 9, confirmando de esta manera tanto la valencia 2 como el valor del peso atómico del elemento anticipados por Mendeleiev.
En resumen, Mendeleiev hizo predicciones detalladas acerca de las propiedades de elementos entonces desconocidos, basado en huecos de su tabla periódica. El descubrimiento de tres de los elementos predichos durante su tiempo (galio, escandio y germanio) otorgaron un fuerte sustento a su tabla. Las propiedades observadas en los nuevos elementos resultaron muy parecidas a las predichas por Mendeleiev años antes, una circunstancia decisiva que ayudó a convencer a la comunidad científica que sus ideas eran correctas.
Mendeleiev es considerado el indisputable inventor de la Tabla Periódica (Scherri, 2007), aún cuando se lo compara con la importante contribución de Lothar J. Meyer. Después de todo Meyer elaboró su tabla un poco antes y tenía el aspecto de las tablas modernas. También, predijo la existencia del germanio. Sin embargo, Meyer publicó su tabla después que lo hiciera Mendeleiev. La tabla de Mendeleiev contenía todos los elementos conocidos en la época, mientras que la Meyer no. Las predicciones de Mendeleiev fueron mucho más numerosas y detalladas que las de Meyer. Durante las décadas de 1870 y 1880 los científicos continuaron llenando los huecos de la Tabla Periódica con el descubrimiento de nuevos elementos a un ritmo aproximado de uno por año. A inicios de los 1890’s se confiaba en encontrar los restantes ‘eka-elementos’ predichos para completar la tabla tal como era conocida en la época. Entonces sucedió algo inesperado: el descubrimiento de elementos sin afinidades químicas!
2. Descubrimiento de los gases nobles por Lord Rayleigh y W. Ramsay: una Tabla Periódica ampliada en toda una nueva columna
Descubrimiento del argón
John William Strutt, también conocido como Lord Rayleigh (físico Británico, 1842-1919) trabajó en la determinación precisa de la densidad de gases durante 20 años. En el caso del nitrógeno hizo una serie de determinaciones basadas en remover oxígeno del aire (Lord Rayleigh, 1894), usando un método de preparación originalmente diseñado por Harcourt y recomendado a él por William Ramsay (químico Escocés, 1852-1916). Aire burbujeado a través de amoníaco líquido se hacía pasar por un tubo conteniendo cobre al rojo vivo donde el oxígeno de aire era consumido por el hidrógeno del vapor de amoníaco mediante la reacción,
siendo el exceso de amoníaco subsecuentemente removido mediante ácido sulfúrico y el agua formada eliminada por secado (en este caso el cobre incandescente servía meramente para promover la reacción y actuar como un indicador). A pesar de haber obtenido una serie concordante de observaciones sobre el gas preparado de la manera descripta, sin embargo, Rayleigh consideró deseable emplear otros métodos de preparación de nitrógeno para confirmar los resultados. Para este propósito, siguió un procedimiento donde no se empleaba amoniaco y el aire era pasado directamente sobre cobre al rojo vivo para remover el oxígeno mediante la reacción de oxidación,
De nuevo, Rayleigh obtuvo una serie de medidas consistentes entre sí, pero para su sorpresa y disgusto las densidades obtenidas por los dos métodos diferían en una milésima parte (0.1%), realmente una pequeña diferencia pero aún mucho más grande que el error experimental. El método con amoniaco conducía a la densidad menor; así surgía la cuestión si la diferencia podría ser atribuida a impurezas reconocidas, posibilidad que Rayleigh descartó. En lugar de tratar de disminuir las diferencias, por el contrario Rayleigh siguió el procedimiento opuesto (Lord Rayleigh, Nobel Lecture, 1904):
‘It is a good rule in experimental work to seek to magnify a discrepancy when it first presents itself, rather than to follow the natural instinct of trying to get quit of it’
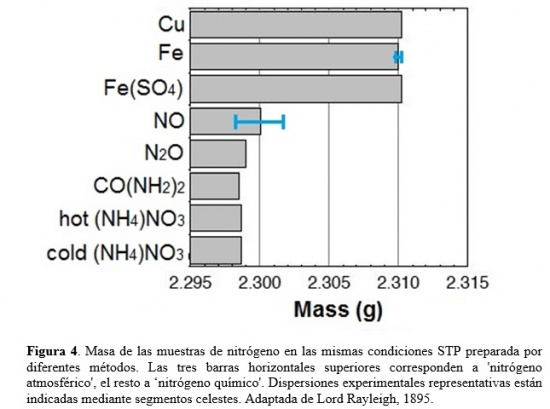
¿Cuál era la diferencia entre los dos tipos de nitrógeno? Aquél obtenido por el segundo método era enteramente derivado del aire; el obtenido burbujeando aire en NH3 líquido provenía del aire sólo parcialmente pues cerca de un quinto se originaba en el amoniaco. El procedimiento más prometedor para magnificar la discrepancia pareció ser la sustitución de aire por oxígeno puro en el método con amoniaco, de manera que todo el nitrógeno debiera en este caso derivarse de amoniaco, de acuerdo con la reacción de Ec. (1). Ahora el nitrógeno amoniacal resultó ser 1/200 (0.5%) más liviano que aquél derivado del aire. Para confirmar que la discrepancia observada revelaba una diferencia entre nitrógenos ‘químico’ y ‘atmosférico’, Rayleigh preparó ambos gases por diversos métodos. Para eliminar el oxígeno del aire, además de usar cobre al rojo vivo, también empleó la oxidación de hierro al rojo vivo y una solución alcalina de sulfato ferroso (FeSO4), obteniendo de esta manera nitrógeno atmosférico. Por ejemplo, empleando hierro incandescente, obtuvo para la masa media (dispersión) en condiciones estándar de temperatura y presión (STP) el valor 2,3100(1) gr. Además de usar amoníaco, también preparó nitrógeno químico derivado de otros compuestos conteniendo este elemento, tales como óxido nítrico (NO), óxido nitroso (NO2), urea [CO(NH2)2], y nitrato de amonio [(NH4)NO3]. Por ejemplo, la masa de nitrógeno obtenido a partir de NO en las mismas condiciones STP anteriores fue de 2,3001(16) gr. Los resultados de Rayleigh para la masa de nitrógeno atmosférico y químico obtenida por diversos métodos se muestran en la Figura 4.
Entre las posibles explicaciones, surgieron entonces las siguientes hipótesis más probables:
(i) la presencia en el aire de un gas más pesado que el nitrógeno, ó
(ii) la existencia en el gas preparado a partir de amoniaco de nitrógeno en un estado disociado (en un principio, favorecida por algunos amigos químicos de Rayleigh).
Dado que tal nitrógeno disociado sería probablemente inestable y finalmente re combinaría al nitrógeno molecular normal, se mantuvo la muestra por ocho meses para encontrar al cabo de ese tiempo que la densidad permaneció inalterada. Así, los resultados apuntan a la primera explicación y debe aceptarse la posible existencia en la atmosfera de un ingrediente desconocido. El próximo paso fue el aislamiento de este componente mediante la remoción del nitrógeno. Esta tarea resultó de una dificultad considerable y fue emprendida por Rayleight y Ramsay, trabajando inicialmente en forma independiente pero luego en forma concertada, empleando dos métodos (Ramsay, 1896):
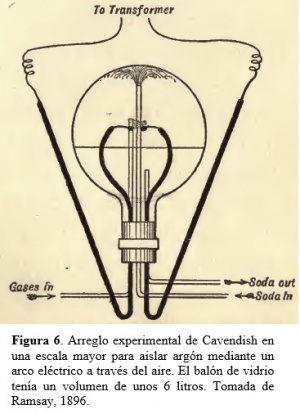
(i) Uno mediante el cual Henry Cavendish (físico y químico Ingles, 1731-1810) había establecido originalmente la identidad del componente principal de la atmosfera con el nitrógeno del nitro, consistente en la oxidación del nitrógeno bajo la influencia de una chispa eléctrica seguida de la absorción del ácido formado por un álcali (Figura 5).
(ii) El otro método consistió en absorber el nitrógeno mediante magnesio al rojo vivo. Con ambos métodos se aisló un gas en una cantidad igual al 1% del aire en volumen, que presentaba una densidad de alrededor de una vez y media la del nitrógeno. Basado en el método de preparación, se probó que el gas no era oxidable ni absorbido por el magnesio a alta temperatura. Varios y diversos intentos de inducir combinaciones químicas del nuevo elemento también resultaron infructuosos. Por esta razón se le dio el nombre de argón (del vocablo Griego que indica ‘inactivo’). El nuevo gas fue sometido por ambos investigadores a observaciones espectroscópicas. Rayleigh observó directamente el arco eléctrico generado en su arreglo experimental de Canvendish, mientras Ramsay analizó la luz emitida por una muestra de gas (obtenida empleando el método con magnesio al rojo vivo) a baja presión dentro de un tubo de Pfliicker cuyos electrodos estaban conectados a una bobina de Ruhmkorff. Junto a las bandas características de nitrógeno residual, ellos observaron grupos adicionales de líneas rojas y verdes que no parecían pertenecer al espectro de ningún gas conocido entonces. Otra notable propiedad del gas fue que el cociente entre sus calores específicos observados a presión y a volumen constante (cp/cv) resultó ser cercano a 5/3, como es de esperar a partir de la termodinámica estadística de elementos monoatómicos. El descubrimiento del nuevo elemento ocurrió el 13 de Agosto de 1894 y fue publicado en Lord Rayleigh y Ramsay, 1895a, 1895b. de ensayo. Los terminales de platino (DD) de los conductores recibían la corriente del circuito secundario de una bobina de Ruhmkorff alimentada por cinco baterías de Grove. Redibujada de Lord Rayleigh y Ramsay, 1895b.
Para una completa investigación sobre las propiedades del nuevo gas descubierto, argón, fue necesario el prepararlo en cantidades a una escala mayor que la hasta ese momento intentada, y esto fue llevado a cabo mediante los dos procesos mencionados para remover el oxígeno y el nitrógeno. A partir de medidas preliminares de la densidad del argón, resultó que el aire debiera contener aproximadamente menos de una parte de este elemento en cien de aire. Así, para obtener un litro de argón, era necesario trabajar con alrededor de 100 litros de aire. Para ello, el arreglo experimental de Cavendish de la Figura 5 (limitado a aislar sólo unos pocos centímetros cúbicos de argón) fue reemplazado por el dispositivo experimental de mayores dimensiones de la Figura 6. En el balón de la Fig. 6 se establece un arco eléctrico entre los electrodos de platino, a través de aire rico en oxígeno colocado sobre una solución débil de soda cáustica (NaOH). Esta soda entra el balón con caudal constante a modo de una fuente que fluye hacia abajo cubriendo la superficie interior con una delgada lámina de líquido. Esto promueve la formación inicial de óxido nítrico, NO, que luego reacciona parcialmente con oxígeno para formar peróxido de nitrógeno, NO2. Este gas es absorbido por la soda, dando lugar a una mezcla de nitrito y nitrato de sodio, NaNO2 y NaNO3, que es entonces removido del balón de reacción. Mediante este procedimiento, se podían combinar entre 7 y 8 litros de aire por hora. Así, para obtener un litro de argón a STP era necesario correr el experimento durante unas 14 horas. La preparación de cantidades apreciables de argón mediante una versión ampliada del experimento basado en la absorción de nitrógeno atmosférico mediante magnesio al rojo vivo resultó lento, complicado, tedioso y de baja producción. En efecto, el obtener un litro de argón ¡podría demandar varios días! Por aquél entonces (1896), las únicas fuentes de argón eran el aire, gases extraídos de aguas minerales o surgentes naturales, un meteorito, y unos pocos minerales raros. Hubo al principio cierta resistencia en aceptar el argón como un nuevo elemento, particularmente porque no había lugar para él en la Tabla Periódica tal como existía entonces, debido a la carencia de elementos conocidos que compartieran propiedades químicas y físicas con este gas noble y también debido a que su masa atómica resultó ser intermedia entre las del potasio y calcio, elementos con los cuales el inactivo argón no comparte ninguna propiedad (el correcto ordenado por número atómico Z y no por masa atómicas, que asigna valores de Z iguales a 18, 19 y 20 a Ar, K y Ca, respectivamente, no se conocía por aquél entonces). Pero otros descubrimientos relacionados iban a cambiar drásticamente la situación.
Descubrimiento de helio terrestre
Luego de descubrir con Lord Rayleigh el nuevo elemento argón, Ramsay se propuso la búsqueda de posibles compuestos de este elemento (Ramsay, Nobel Lecture, 1904). Fue entonces cuando se enteró de las observaciones de William F. Hillebrand (geoquímico Estadounidense, 1853-1925) quién notó que ciertos minerales, especialmente aquellos conteniendo uranio (como la pechblenda, ahora llamada uraninita, básicamente UO2), liberan gases cuando son calentados en soluciones diluidas de acido sulfúrico. Ramsay pensó que este gas podría ser argón, mezclado con nitrógeno. Sin embargo, cuando examinó el espectro de emisión del gas, encontró una línea amarilla inesperadamente brillante. Mediante comparación con una lista de líneas espectrales reportadas, estableció la coincidencia con una línea previamente observada por diversos investigadores en la luz de la cromosfera durante el eclipse solar del 18 de Agosto de 1868. Esto fue confirmado por Jules Janssen (astrónomo Francés, 1824-1907), quien registró la línea espectral (587.49 nm de longitud de onda) durante el eclipse, y también por Norman Lockyer (científico y astrónomo Inglés, 1836-1920) quien la observo desde las Islas Británicas. Se debe a Lockyer y Edward Frankland (químico Británico, 1825-1899) la conclusión (luego de infructuosas pruebas para ver si se trataba de algún nuevo tipo de hidrógeno) que podría deberse a un elemento aún no descubierto. Esta es la primera vez que se revela la existencia de un elemento químico en un cuerpo extra-terrestre antes de ser encontrado en la Tierra. Lockyer y Frankland bautizaron el elemento con el nombre Griego del Sol: helio.
El descubrimiento del helio terrestre fue reportado por Ramsay el 25 de Abril de 1895 (Ramsay, 1895) y, en forma independiente más tarde ese mismo año, por Nils Abraham Langlet (químico Sueco, 1868-1936), trabajando en el laboratorio de Per Teodor Cleve (químico Sueco, 1840-1905), quienes colectaron suficiente gas para hacer medidas precisas del peso atómico (Langlet, 1895). El helio, como el argón, es gaseoso, poco soluble en agua, resiste la acción del oxígeno en presencia de soda caústica o bajo la influencia de un arco eléctrico, como así también el reaccionar con magnesio incandescente. Al igual que el argón, el cociente cp/cv es 1.67, de nuevo indicando que se trata de un gas monoatómico y su densidad resultó ser próxima a 2 veces la del H2; se concluyó entonces que se trata del gas más liviano conocido, con la excepción del hidrógeno. Estas propiedades en común ponen en evidencia que el helio y el argón pertenecen a la misma familia natural.
Ahora Ramsay contaba con dos miembros de la familia de gases raros, suficiente para proponer en 1896 el agregado de una octava columna a la Tabla Periódica, siguiendo la de los halógenos (ver Tabla 5). De la mayor importancia, también resultó evidente que una inspección de la tabla ampliada sugería claramente que al menos debían existir otros tres elementos de la misma clase. Siguiendo esta convicción, Ramsay predijo en 1897 la existencia de ‘un nuevo elemento’ con peso atómico 20 (Ramsay, 1897), a pesar que igualmente podría haber mantenido con casi la misma probabilidad que otros dos elementos también esperaban ser descubiertos.
Descubrimiento de otros miembros de la familia de gases nobles
Con la ayuda de su asistente de laboratorio Morris W. Travers (químico Británico, 1872-1961), Ramsay desarrolló durante 1896-1897 un plan de investigación centrado en la búsqueda de los gases predichos. Estudiaron gases liberados por minerales, meteoritos y surgentes naturales. También, empleando los métodos químicos descriptos antes, a finales de Diciembre de 1898 prepararon 15 litros de argón atmosférico, dado que sospechaban que era impuro y que contenía otros tres gases nobles.
Sin embargo, justamente la misma propiedad que facilitaba el aislamiento de argón por medios químicos, esto es su inercia en reacciones químicas que consumían los otros constituyentes reactivos del aire, por el otro lado evitaba la separación química de otros gases que pudieran estar mezclados con él. Fue entonces cuando un método físico llegó al rescate: la destilación fraccionada a bajas temperaturas. Favorecidos por las muy distintas temperaturas de ebullición de los nuevos elementos inertes y la disponibilidad de mejores licuefactores en Inglaterra, debido principalmente al trabajo de Williams Hampson (ingeniero y científico Británico autodidacta, 1854-1926), Ramsay y Travers hicieron un hábil uso de la destilación fraccionada como un método para aislar los otros miembros de la familia de gases nobles. Esto dio lugar a una secuencia impresionante de descubrimientos alcanzados en un tiempo relativamente corto. Hampson proveyó a Ramsay con alrededor de un litro de aire liquido (que contiene aproximadamente unos 70 litros de argón a STP). Luego de manipular el líquido, quedaron alrededor de 100 c.c. Dejando evaporar la mayor parte, aún restaron 10 c.c. que fueron entonces evaporados en un recipiente. Luego de remover el oxígeno y el nitrógeno, restaron 26 c.c. de un gas cuyo espectro mostró, junto a las líneas del argón, un par de líneas de emisión brillantes de color amarillo y verde, con longitudes de onda de 5571 y 5570,5 Å, respectivamente. Estas líneas resultaron ser la signatura espectroscópica de un nuevo elemento de gas noble que fue nombrado ‘kriptón’, palabra Griega que significa ‘escondido’. La densidad medida de la mezcla Kr/Ar de gases resultó de sólo 22,5 veces la del hidrógeno, pero los cálculos indicaban que, cuando purificada, resultaría ser cuarenta veces más pesado que el hidrógeno (implicando una masa atómica de alrededor de 80) debido a que experimentos previos establecieron que, como el argón y el helio, el kriptón era un gas mono-atómico. Este descubrimiento fue comunicado a la Royal Society el 3 de Junio de 1898 (Ramsay y Travers, 1898a). Sin pérdida de tiempo, Ramsay and Travers examinaron los anteriormente mencionados 15 litros of argón mediante licuefacción y destilación fraccionada. El 16 de Junio de 1898, anuncian que las porciones de menor temperatura de ebullición contenían un gas que llamaron ‘neón’ por ‘nuevo’ (Ramsay y Travers, 1898b); el gas mostraba un espectro de emisión hasta entonces desconocido, caracterizado por varias líneas brillantes de color rojo, anaranjado y amarillo.
En Septiembre de 1898, Ramsay y Travers anuncian el descubrimiento de aún otro gas; fue separado del kriptón por destilación fraccionada y posee una temperatura de ebullición todavía mayor. Lo nombraron de ‘xenón’, que significa ‘extraño’ (Ramsay y Travers, 1898c). Friedrich E. Dorn (físico Alemán, 1848–1916) descubre en 1900 un sexto producto gaseoso químicamente inerte (que resultó ser radio-activo) a partir del radio, y lo llama simplemente ‘emanación’ (Dorn, 1900). Pero fueron Ramsay y Robert Whytlaw-Gray (químico Inglés, 1877-1958) quiénes en 1908 lo aislaron por primera, midieron su densidad y determinaron que se trata del más pesado de todos los gases entonces conocidos (Gray y Ramsay, 1909). Desde 1923 es conocido como radón.
Referencias
Dorn, F. E. (1900). "Über die von radioaktiven Substanzen ausgesandte Emanation". Abhandlungen der Naturforschenden Gesellschaft zu Halle. Stuttgart. 22, 155. Gray, R. W. y W. Ramsay, W. (1909). "Some Physical Properties of Radium Emanation". J. Chem. Soc. Trans. 95, 1073–1085.
Langlet, N. A. (1895). "Das Atomgewicht des Heliums". Zeitschrift für Anorganische Chemie 10 (1), 289-292.
Lord Rayleigh (1894). “The density of nitrogen gas”. Nature 50, 157-159.
Lord Rayleigh (1895). “Argon”. Proc. Roy. Inst. 14, 524-538.
Lord Rayleigh (1904). “The density of gases in the air and the discovery of argon”. Nobel Lecture. http://nobelprize.org/nobel_prizes/physics/laureates/1904/strutt-lecture.html
Lord Rayleigh y Ramsay, W. (1895a). "Argon, a New Constituent of the Atmosphere". Proceedings of the Royal Society of London 57(1), 265-287.
Lord Rayleigh y Ramsay, W. (1895b). "VI. Argon: A New Constituent of the Atmosphere". Phil. Trans. Roy. Soc. A. 186, 187-241.
Mendeleev, D. I. (1869). “Sootnoshernic svoistv s atomnym vesom elementov”. Zhurnal Russkeo Fizikp-Khimicheskoe Obshchestv 1, 60-77.
Mendeleev, D. I. (1871). “Estestvennaya sistema elementov i primenie ee k ukazaniyu svoistv neotkrytykh elementov”. Zhurnal Russkeo Fiziko-Khimicheskoe Obshchestvo, 3, 25–56.
Meyer, J. L. (1870). “Die Natur der Chemischen Elements als Function ihrer Atomgewichte”. Annalen der Chemie, Supplementband, 7, 354-364.
Ramsay, W. (1895). "On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3, One of the Lines in the Coronal Spectrum. Preliminary Note". Proceedings of the Royal Society of London 58, 65–67.
Ramsay, W. (1896). The Gases of the Atmosphere: The History of Their Discovery. London: McMillan.
Ramsay, W. (1897). “An Undiscovered Gas”. Nature 56, 378.
Ramsay, W. (1904). “The Rare Gases of the Atmosphere”, Nobel Lecture. https://www.nobelprize.org/prizes/chemistry/1904/ramsay/lecture/
Ramsay, W. y Travers, M. W. (1898a). "On a New Constituent of Atmospheric Air". Proceedings of the Royal Society of London 63(1), 405–408.
Ramsay, W. y Travers, M. W. (1898b). "On the Companions of Argon". Proceedings of the Royal Society of London 63(1), 437–440.
Ramsay, W. y Travers, M. W. (1898c). "On the extraction from air of the companions of argon and neon". Report of the Meeting of the British Association for the Advancement of Science, 828. Saunders, N. (2012). Who invented the periodic table?. Encyclopædia Britannica, Cambridge: University Press.
Scherri, E. R. (2007). The Periodic Table. Oxford: University Press.
Debug data: