La tabla períodica de elementos
Sesquicentenario de la Tabla Periódica de Mendeleiev Oscar E. Piro Instituto IFLP (CONICET) y Departamento de Física, FCE, UNLP, CC 67, (1900) La Plata
Resumen La aparentemente insondable complejidad de las propiedades fisicoquímicas de una lista creciente de elementos químicos descubiertos y su virtualmente infinito número de compuestos estimuló a los científicos en la búsqueda de regularidades y patrones de comportamiento de dichos elementos. El resultado fue la Tabla Periódica de los Elementos Químicos, una sucinta organización del conocimiento acumulado durante siglos. Es una notable demostración que los elementos no son una mera colección de entidades al azar sino que exhiben tendencias y se organizan en familias. La Tabla Periódica es una referencia esencial en el entendimiento de la estructura y propiedades de la materia. Aquí hacemos una breve descripción del desarrollo histórico de la Tabla Periódica hasta fines del siglo XIX, uno de los logros más significativos de la ciencia que captura aspectos esenciales de la química y la física. Trabajo en prensa aceptado para el número 8 de la revista NUCLEOS de la Editorial UNNOBA
1. La evolución de la Tabla Periódica
Principios guía históricos para construir la Tabla Los elementos se asocian en grupos basados en similaridades en sus propiedades químicas y físicas. Presentan también ciertas conspicuas regularidades numéricas en sus masas atómicas relativas. Por ejemplo, la masa atómica de un miembro de grupo parece coincidir con el promedio de las masas atómicas de los elementos por arriba y debajo de él. Así, por ejemplo, la media de los pesos atómicos del calcio y bario da una buena aproximación al peso atómico del estroncio; el del sodio es cercano al valor medio de los pesos atómicos del litio y potasio; similarmente, azufre y telurio indican al selenio como el elemento del medio.
1.1. Las triadas de J. W. Döbereiner
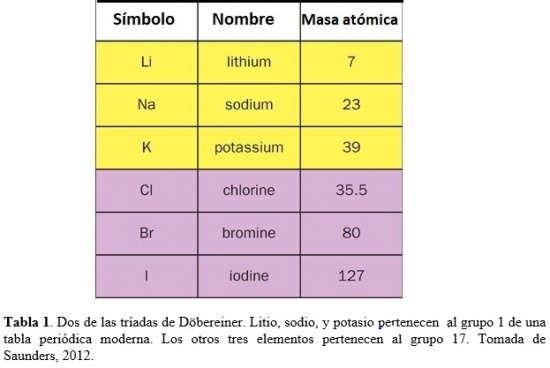
Durante los años 1820’s, Johann Wolfgang Döbereiner (químico Alemán, 1780-1849) notó que ciertos elementos formaban patrones. Por ejemplo, que el litio, sodio, y potasio tenían propiedades parecidas. Todos estos metales son blandos y livianos pero muy reactivos. Si se los lista en orden creciente de masas atómicas relativas, ese orden es también el de reactividad creciente. Cloro, bromo e iodo son no-metales muy reactivos que, en particular, se combinan fácilmente con el sodio dando lugar a cristales blancos de fórmula química NaX. Si se los lista en orden de masas atómicas relativas crecientes, ellos se disponen en orden de reactividad decreciente (Saunders, 2012). Döbereiner llamó a tales familias de tres elementos triadas (ver Tabla 1). Basado en valores para las masas atómicas relativas reportados por Jöns Jacob Berzelius (químico Sueco, 1779-1848), notó que la masa atómica del elemento del medio en cada tríada era el promedio de los otros dos. Las triadas de Döbereiner fueron un primer intento de agrupar los elementos y mostrar que podrían estar relacionados entre sí a través de sus masas atómicas.
Las tríadas de Döbereiner fueron extendidas por otros químicos para incluir más de los tres elementos originales. Por ejemplo, se agregó el flúor encima de la tríada conteniendo cloro, bromo, e iodo. Se propusieron también otras ‘triadas’, tal como una conteniendo oxígeno, azufre, selenio, y teluro. Pero no se disponía de un sistema que conectara todas estas asociaciones. Uno de los problemas consistía en que los valores de muchas masas atómicas relativas eran entonces incorrectos.
1.2. La espiral telúrica de A.-E. de Chancourtois
En 1862, Alexandre-Emile de Chancourtois (geólogo Francés, 1820–1886) construyó una tabla periódica colocando los elementos en orden creciente de masas atómicas. Para ello usó los valores más precisos de la época, particularmente aquellas basada en el trabajo de Stanislao Cannizzaro (químico Italiano, 1826-1910), quien resolvió el problema de las grandes variaciones en masas atómicas calculadas por diferentes químicos. De Chancourtois dibujó su tabla sobre un papel enrollado alrededor de un cilindro, formando una espiral con el teluro a mitad del camino descendente, de allí el origen de su nombre (ver Fig. 1).
En un cilindro de de Chancourtois con 16 unidades de masa perimetrales, las tríadas de Döbereiner aparecen en columnas verticales. También, las propiedades de los elementos sobre la espiral se repiten con cada vuelta alrededor del cilindro. De Chancourtois fue el primero en colocar los elementos conocidos entonces en orden creciente de sus masas atómicas y encontrar un patrón repetitivo. A pesar de algunos méritos, la espiral fue ignorada por los químicos. Algunas de sus partes mostraban tendencias generales pero otras no y era difícil de usar.
1.3. Ley de las octavas de J. Newlands
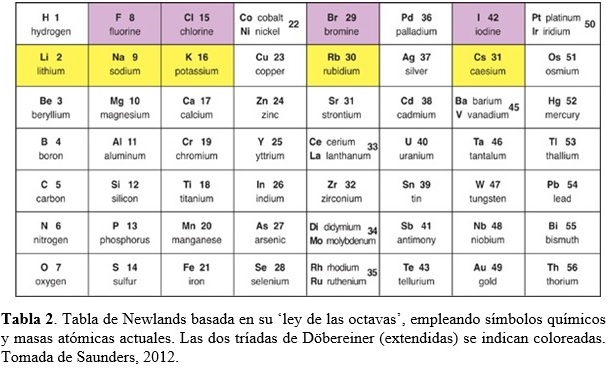
En 1865, John Newlands (químico Ingles, 1837-1898) publica una tabla plana donde arregla los elementos conocidos en orden creciente de sus masas atómicas, tal como lo hiciera de Chancourtois (Tabla 2). “When elements are arranged in increasing order of their atomic mass, the eighth element resembles the first in physical and chemical properties just like the eighth note on a musical scale resembles the first note.” John Newlands
Debug data: