La tabla períodica de elementos
Sesquicentenario de la Tabla Periódica de Mendeleiev Oscar E. Piro Instituto IFLP (CONICET) y Departamento de Física, FCE, UNLP, CC 67, (1900) La Plata
Resumen La aparentemente insondable complejidad de las propiedades fisicoquímicas de una lista creciente de elementos químicos descubiertos y su virtualmente infinito número de compuestos estimuló a los científicos en la búsqueda de regularidades y patrones de comportamiento de dichos elementos. El resultado fue la Tabla Periódica de los Elementos Químicos, una sucinta organización del conocimiento acumulado durante siglos. Es una notable demostración que los elementos no son una mera colección de entidades al azar sino que exhiben tendencias y se organizan en familias. La Tabla Periódica es una referencia esencial en el entendimiento de la estructura y propiedades de la materia. Aquí hacemos una breve descripción del desarrollo histórico de la Tabla Periódica hasta fines del siglo XIX, uno de los logros más significativos de la ciencia que captura aspectos esenciales de la química y la física. Trabajo en prensa aceptado para el número 8 de la revista NUCLEOS de la Editorial UNNOBA
1. La evolución de la Tabla Periódica
Principios guía históricos para construir la Tabla Los elementos se asocian en grupos basados en similaridades en sus propiedades químicas y físicas. Presentan también ciertas conspicuas regularidades numéricas en sus masas atómicas relativas. Por ejemplo, la masa atómica de un miembro de grupo parece coincidir con el promedio de las masas atómicas de los elementos por arriba y debajo de él. Así, por ejemplo, la media de los pesos atómicos del calcio y bario da una buena aproximación al peso atómico del estroncio; el del sodio es cercano al valor medio de los pesos atómicos del litio y potasio; similarmente, azufre y telurio indican al selenio como el elemento del medio.
1.1. Las triadas de J. W. Döbereiner
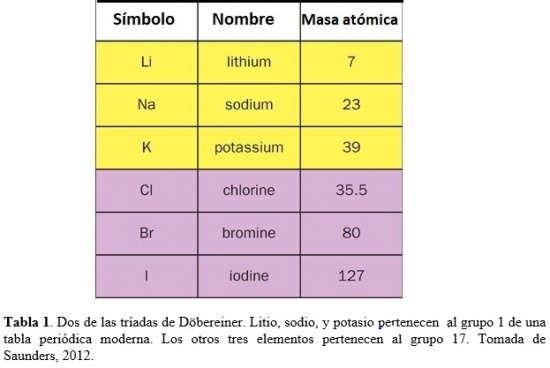
Durante los años 1820’s, Johann Wolfgang Döbereiner (químico Alemán, 1780-1849) notó que ciertos elementos formaban patrones. Por ejemplo, que el litio, sodio, y potasio tenían propiedades parecidas. Todos estos metales son blandos y livianos pero muy reactivos. Si se los lista en orden creciente de masas atómicas relativas, ese orden es también el de reactividad creciente. Cloro, bromo e iodo son no-metales muy reactivos que, en particular, se combinan fácilmente con el sodio dando lugar a cristales blancos de fórmula química NaX. Si se los lista en orden de masas atómicas relativas crecientes, ellos se disponen en orden de reactividad decreciente (Saunders, 2012). Döbereiner llamó a tales familias de tres elementos triadas (ver Tabla 1). Basado en valores para las masas atómicas relativas reportados por Jöns Jacob Berzelius (químico Sueco, 1779-1848), notó que la masa atómica del elemento del medio en cada tríada era el promedio de los otros dos. Las triadas de Döbereiner fueron un primer intento de agrupar los elementos y mostrar que podrían estar relacionados entre sí a través de sus masas atómicas.
Las tríadas de Döbereiner fueron extendidas por otros químicos para incluir más de los tres elementos originales. Por ejemplo, se agregó el flúor encima de la tríada conteniendo cloro, bromo, e iodo. Se propusieron también otras ‘triadas’, tal como una conteniendo oxígeno, azufre, selenio, y teluro. Pero no se disponía de un sistema que conectara todas estas asociaciones. Uno de los problemas consistía en que los valores de muchas masas atómicas relativas eran entonces incorrectos.
1.2. La espiral telúrica de A.-E. de Chancourtois
En 1862, Alexandre-Emile de Chancourtois (geólogo Francés, 1820–1886) construyó una tabla periódica colocando los elementos en orden creciente de masas atómicas. Para ello usó los valores más precisos de la época, particularmente aquellas basada en el trabajo de Stanislao Cannizzaro (químico Italiano, 1826-1910), quien resolvió el problema de las grandes variaciones en masas atómicas calculadas por diferentes químicos. De Chancourtois dibujó su tabla sobre un papel enrollado alrededor de un cilindro, formando una espiral con el teluro a mitad del camino descendente, de allí el origen de su nombre (ver Fig. 1).
En un cilindro de de Chancourtois con 16 unidades de masa perimetrales, las tríadas de Döbereiner aparecen en columnas verticales. También, las propiedades de los elementos sobre la espiral se repiten con cada vuelta alrededor del cilindro. De Chancourtois fue el primero en colocar los elementos conocidos entonces en orden creciente de sus masas atómicas y encontrar un patrón repetitivo. A pesar de algunos méritos, la espiral fue ignorada por los químicos. Algunas de sus partes mostraban tendencias generales pero otras no y era difícil de usar.
1.3. Ley de las octavas de J. Newlands
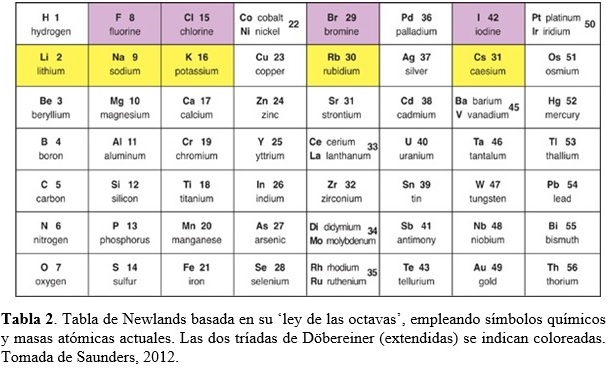
En 1865, John Newlands (químico Ingles, 1837-1898) publica una tabla plana donde arregla los elementos conocidos en orden creciente de sus masas atómicas, tal como lo hiciera de Chancourtois (Tabla 2). “When elements are arranged in increasing order of their atomic mass, the eighth element resembles the first in physical and chemical properties just like the eighth note on a musical scale resembles the first note.” John Newlands
Newlands llamó a su invención “ley de las octavas”. Una octava consistía de un primer elemento, el octavo elemento después del primero, y los seis elementos entre el primero y el octavo. Así, el litio y el sodio se sitúan en los extremos opuestos de una octava. El oxígeno y el azufre en los extremos opuestos de una octava diferente. De esta manera, elementos con propiedades similares aparecían en la misma fila de la tabla (ver Tabla 2). La primera columna de su tabla contenía los elementos del hidrógeno al oxigeno, los mismos siete elementos que en la primera espira de la espiral telúrica de de Chancourtois, y las tríadas de Döbereiner aparecían en sus filas. Desafortunadamente, el arreglo en octavas de Newlands no resultó exitoso y solo funcionaba hasta el calcio. Más allá, la tabla resultaba químicamente inconsistente. Por ejemplo, el hierro estaba en la misma fila que el oxígeno y el azufre. El cobre, un metal muy poco reactive, estaba posicionado entre el potasio y el rubidio, dos metales muy reactivos. Newlands incluyó en su tabla todos los elementos conocidos en su época, pero continuamente se descubrían nuevos elementos para los cuales no tenía cabida en las últimas versiones de su arreglo (Saunders, 2012). Históricamente, la tabla de Newlands puede considerarse un avance porque no solo ordenó los elementos de acuerdo a masas atómicas crecientes, sino que encontró en dicho arreglo algunos patrones repetitivos en las propiedades químicas. A pesar que partes de su tabla eran confusas, la misma fue el primer intento en elaborar una tabla periódica tal como la conocemos actualmente.
1.4. Tabla basada en la valencia química de J. L. Meyer
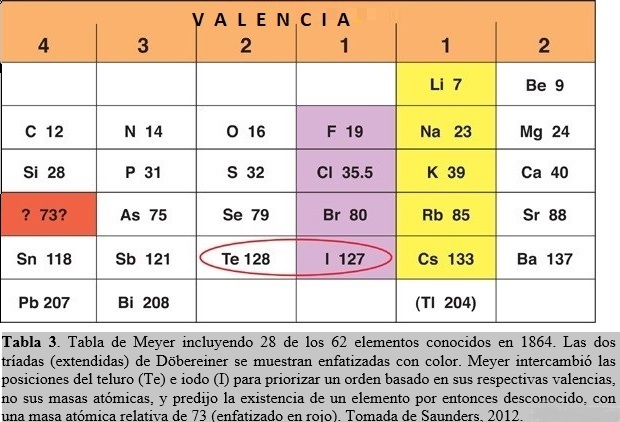
En 1864, Julius Lothar Meyer (químico Alemán, 1830-1895) inventó una tabla donde, como en las de de Chancourtois y de Newlands, los elementos estaban arreglados en orden creciente de masas atómicas. Pero a diferencia con éstos últimos, Meyer arregló los elementos en seis columnas, basado en su capacidad para formar enlaces químicos. Cada elemento en una misma columna presentaba la misma valencia, esto es, sus átomos podían formar el mismo número de enlaces. Estaba tan convencido que esta era la forma correcta de posicionar los elementos en la tabla que hasta intercambió el orden (dictado por las masas atómicas) de dos elementos. El teluro posee una masa atómica relativa mayor que el iodo, por lo que éste último elemento debería anteceder al primero. Pero Meyer permutó sus posiciones en favor de acordar con un orden basado en sus respectivas valencias, no sus masas atómicas (Tabla 3).
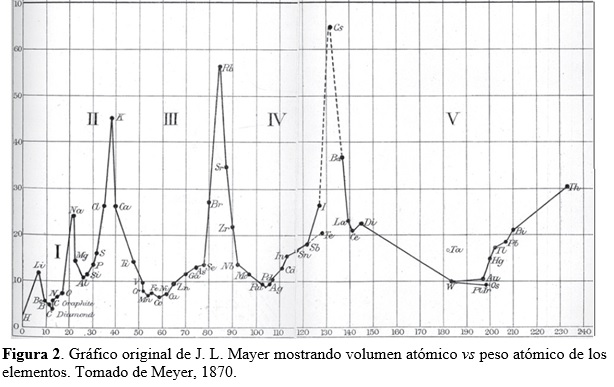
Meyer examinó la diferencia entre las masas atómicas de elementos en columnas adyacentes y pertenecientes a la misma fila de la tabla y notó que, en general, era un número pequeño (alrededor de dos). Para mantener este patrón, tuvo que desplazar un lugar hacia abajo a dos elementos de la columna izquierda de su tabla. Esto implicó la generación de un hueco en la misma que podría corresponder a un elemento aún no descubierto, con una masa atómica estimada en alrededor de 73 (ver Tabla 3). Posiblemente el mayor aporte de Meyer yace en su énfasis sobre propiedades físicas, tales como volúmenes atómicos, densidades y fusibilidades, para dilucidar el comportamiento periódico de los elementos. En particular, publicó un revelador diagrama mostrando la periodicidad exhibida por los volúmenes atómicos de los elementos (Fig. 2). Estos volúmenes pueden calcularse a partir de medidas de densidad (ρ) en el estado condensado (líquido, sólido) de los elementos. En efecto, consideremos un átomo gramo A de un elemento ocupando un volumen V, entonces ρ = A/V. Debido a que existe en A gramos un número de Avogadro NA de átomos, que están empaquetados de manera muy compacta en el condensado, podemos asociar un volumen v por átomo de acuerdo a V = NAv, obteniendo de esta manera para el ‘volumen atómico’ la expresión v = A/NA ρ ó v proporcional a A/ρ.
El hacer predicciones razonables que resulten más tarde verificadas por la experiencia constituye una importante característica del avance de la ciencia. En este aspecto, la tabla de Meyer podría haber sido un reconocido éxito científico a no ser por una seria limitación: sólo contenía 28 de los 62 elementos conocidos entonces. A pesar que trató de ordenar otros 22 elementos en una tabla separada, sus esfuerzos no culminaron con una tabla funcional medianamente completa que facilitara el trabajo de los científicos. En conclusión, la tabla de Meyer constituyó un gran avance debido a que ordenó los elementos de acuerdo a sus masas atómicas relativas y valencias. Tuvo la visión de intercambiar el orden canónico (basado en masas atómicas) de dos elementos (teluro e iodo) para priorizar su esquema de orden basado en valencia y predijo la existencia de un elemento que sería descubierto más tarde (germanio). También mostró que la periodicidad en el comportamiento químico de los elementos tiene su contrapartida en la periodicidad observada de sus respectivas propiedades físicas.
1.5. Tabla de D. I. Mendeleiev
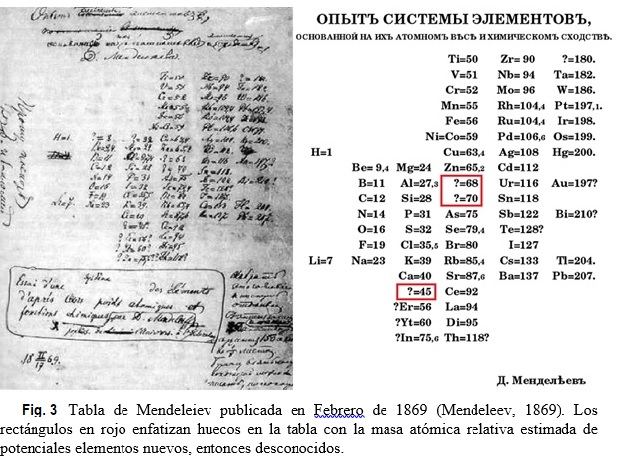
Muy breve biografía: Dimitri Ivanovich Mendeleiev (químico ruso, 1834-1907) era el más joven de catorce hermanos. Su familia no era acaudalada, pero Dimitri era brillante y muy trabajador. En 1855 se graduó en la Universidad Estatal de St. Petersburgo. Mendeleiev asistió a una importante conferencia internacional de química, realizada en 1860 en Karlsruhe, Alemania, donde se encuentra con líderes de la química europea. Más tarde recordaría la presentación de Cannizzaro sobre masas atómicas relativas como particularmente importante en su investigación. En 1865 es nombrado Profesor de la Universidad de St. Petersburgo. Estimulado por su actividad docente como Profesor de química, en 1867 Mendeleiev decide escribir un libro de texto sobre el tema. Durante esta tarea, percibió que algunos elementos químicos poseían propiedades similares y que sería muy útil el diseñar una forma de organizarlos. Mendeleiev elaboró una tarjeta para cada elemento químico conocido. En cada una de ellas, escribió la masa atómica relativa del elemento e información acerca de sus propiedades. Aficionado al juego de cartas, construye una suerte de solitario con las tarjetas y luego trata de organizarlas de todas las maneras posibles, intercambiándolas hasta obtener un arreglo satisfactorio. Este procedimiento le tomó un día, pero había estado pensando sobre el tema en forma discontinua durante años. Mendeleiev publica su primera versión de la tabla periódica en 1869 (ver Fig. 3).
Mendeleiev continúa perfeccionando su tabla, produciendo varias versiones, y publica una explicación detallada de sus ideas en 1871 (Mendeleev, 1871). Su tabla periódica más famosa de ese año estaba arreglada verticalmente, en la misma manera que una tabla moderna (ver Tabla 4). Mendeleiev dispuso los elementos en orden creciente de sus masas atómicas, tal como lo hicieran antes de Chancourtois, Newlands y Meyer. Las filas horizontales fueron llamadas series, similares a los períodos modernos. Los elementos con propiedades similares se disponían según columnas verticales llamadas grupos, como actualmente (Saunders, 2012).
Debug data: