Caracterización de micelas unimoleculares
Caracterización de micelas unimoleculares
Tesis de Licenciatura (Trabajo de Diploma) de Ignacio Bruvera, presentada en Diciembre de 2009 en el Departamento de Física de la Facultad de Ciencias Exactas de la UNLP.
Director: Dr. Marcelo Ceolin
Se entiende por caracterización (la palabra más común en cualquier trabajo experimental) al estudio de las propiedades de un sistema, tanto intrínsecas como respecto a su interacción con otros sistemas y su respuesta a ciertos estímulos. En pocas palabras, se habla de una caracterización cuantitativa cuando, como resultado de la investigación, se obtienen cantidades (números) que definen al sistema. Por ejemplo, la caracterización de una pelota consistiría en determinar su masa, tamaño, color, elasticidad, estructura interna, etc..Por ser la pelota un objeto de dimensiones más o menos humanas,la mayoría de las determinaciones antes mencionadas se pueden realizar mediante medidas más o menos directas; la masa (el peso en realidad) con una balanza, el tamaño con una regla, la estructura interna por inspección visual, etc..En cambio, cuando tratamos con objetos de tamaños menores a los microscópicos que, entre otras cosas, ya no reflejan luz visible ni pueden ser manipulados fácilmente , es necesario recurrir a técnicas más indirectas para obtener información de ellos.
Este es el caso de mi trabajo en donde, el sistema de estudio (las micelas) consiste en moléculas grandes (para ser moléculas) formadas por miles de átomos, principalmente de carbono, hidrógeno y nitrógeno (por lo que se las considera orgánicas) (fig. 1: Modelo tridimensional de una micela unimolecular donde cada esfera representa un átomo). Una micela es una estructura tipo cápsula formada por una o varias moléculas. El ejemplo típico es el del detergente: La molécula de detergente tiene un extremo hidrofílico, es decir, que atrae sustancias como el agua (llamadas polares por tener sus moléculas extremos cargados eléctricamente) y otro extremo hidrofóbico (que repele el agua) que es atraído por las sustancias grasas. Cuando las moléculas de detergente se encuentran con las gotas de grasa insolubles en agua, se pegan a ellas por el extremo hidrofóbico. Así, la grasa queda cubierta por una capa de moléculas que exponen al agua su extremo hidrofílico permitiendo la disolución(fig. 2).
Las micelas unimoleculares se comportan de forma similar excepto que, como su nombre lo indica, no son arreglos de varias moléculas sino, una sola molécula que se pliega (de forma similar a las proteínas) dependiendo del medio, para exponer a este sus secciones polares o no polares. Esta característica las vuelven interesantes por su capacidad de servir como "contenedores" de otras moléculas. Esto sirve tanto a la investigación básica ya que permite estudiar el comportamiento de moléculas confinadas en entornos del orden del nanometro (10^-9m) como a la investigación aplicada por su potencial uso como "nanomoldes" o como vector de transporte de sustancias para aplicaciones médicas.
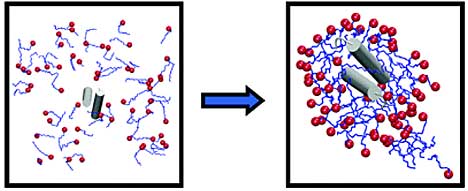
Con esta motivación realicé mi trabajo estudiando primero el comportamiento de las micelas en diferentes medios mediante una técnica basada en la dispersión de luz: se hace incidir luz sobre la suspensión de micelas y se observa cuanta luz es reflejada con un ángulo de 90º. Notamos que, al pasar de un solvente no polar a uno polar (parecido al agua), la intensidad de la luz dispersada aumenta. Como sabemos que, cuanto mayor es el objeto dispersor más luz dispersa, llegamos a la conclusión de que las micelas tienden a agregarse (pegarse unas con otras) cuando se encuentran en un medio polar.
En la segunda etapa, con el fin de estudiar mejor la respuesta de las micelas a distintos medios y a los cambios de temperatura, utilizamos una técnica más sofisticada (que se realiza en Brasil) basada en la dispersión de rayos X a bajo ángulo. En esta, se hacen incidir rayos X sobre la muestra y se observa la radiación dispersada a ángulos pequeños. Esto nos brinda información sobre la forma, el tamaño y la estructura de los objetos dispersores. En este caso notamos un pico de intensidad a un cierto ángulo, similar a los que se observan para estructuras ordenadas de moléculas, como los cristales. El pico desaparece al aumentar la temperatura por lo que suponemos que, a temperaturas relativamente bajas, las micelas se agrupan ordenadamente, algo bastante llamativo para estas grandes moléculas orgánicas.
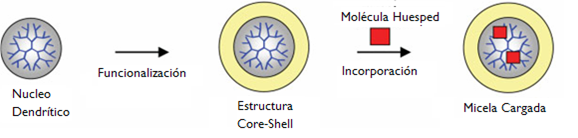
Finalmente, en la dirección de investigar la capacidad de las micelas para contener otras partículas, se estudió la incorporación de colorantes fluorescentes. La fluorescencia es el fenómeno mediante el cual una sustancia absorbe luz de un cierto color (que se corresponde a una cierta energía) para luego emitir luz de energía menor, osea de un color más cercano al rojo en el espectro visible. Se realizó un experimento en donde se pusieron en contacto una solución de micelas en solvente no polar (tolueno) con una solución de colorante en solvente polar (agua).
Por ser uno polar y el otro no polar, las soluciones no se mezclan (como el agua y el aceite). Además, el colorante no es soluble en tolueno y, como ya vimos, las micelas no son solubles en solventes tipo agua (polares). Pero, como el interior de las micelas es polar, se esperaba que algunas moléculas de colorante pasaran de la solución acuosa a la solución orgánica (tolueno) (fig.3 y 4).
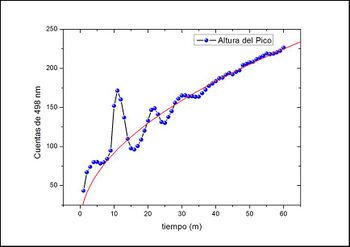
Para observar esto, se midió la fluorescencia (o sea la intensidad del color ) en la fase superior de la muestra en función del tiempo. Naturalmente, al principio esta era nula porque no había colorante en esta fase. Con el correr del tiempo se esperaba un aumento de la señal a medida que las partículas de colorante fueran capturadas por las micelas. Esto se cumplió, pero además se observó un extraña oscilacion en la intensidad de la fluorescencia (fig. 5). Pareciera que las micelas capturan colorante y luego lo devuelven a su medio original de forma periódica. Este comportamiento todavia no ha podido ser explicado.
También quisimos comprobar si micelas cargadas con diferentes colorantes, eran capaces de intercambiar su contenido al entrar en contacto. Para esto utilizamos un fenómeno muy interesante de las sustancias fluorescentes: supongamos que tenemos un colorante A que absorve luz azul y emite amarilla y otro colorante B que absorve amarilla y emite roja. Si iluminamos con luz azúl, deberíamos ver que la muestra emite luz amarilla, pero ,si las moléculas de A y B se encuentran muy cerca entre si, la luz amarilla emitida por A puede ser absorvida por B que luego emite luz roja. Este fenómeno se denomina RET (Resonant Energy Transfer) y se usa para saber cuando dos objetos nanoscópicos se encuentran a corta distancia. Así, cargamos una muestra de micelas con colorante A y otra con colorante B. Luego mezclamos las muestras e iluminamos con luz azul. Observamos que se emitía luz roja, lo que confirmó que había moléculas de A y B muy cerca entre si, osea, dentro de la misma micela. Esto confirmó que las micelas pueden intercambiar su contenido. En resumen, se utilizaron varias técnicas experimentales para obtener información de un sistema poco conocido e interesante con resultados muy ricos que promueven continuar con la investigación.
Debug data: