Niels Bohr
[1885-1962] Nació en Copenhague, Dinamarca, donde se educó y pasó la mayor parte de su vida. Después de doctorarse en 1911 viajó a Inglaterra para trabajar con J.J. Thomson,quien había descubierto el electrón 15 años antes.
Comenzó a trabajar en estructura atómica siguiendo el modelo atómico sugerido por Rutherford, el cual presentaba algunos problemas. De acuerdo con la teoría clásica, toda partícula cargada que es acelerada emite energía, por lo tanto los electrones atómicos al moverse alrededor del núcleo deberían perder energía y caer en espiral hacia el núcleo haciendo colapsar el átomo.
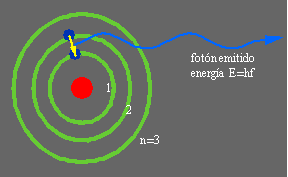
Para resolver este dilema Bohr combinó este modelo atómico con las ideas de cuantificación de la materia propuestas por Plank y por Einstein y en 1913 propuso un nuevo modelo del átomo que era capaz de explicar la estabilidad de la materia y el espectro de emisión del átomo de Hidrógeno. Para ello Bohr formula los postulados de cuantización del momento angular del electrón, y de la energía del electrón en su órbita estable. Según estos postulados los electrones en una órbita estable no emitían radiación. De esta forma los electrones se encontraban en niveles de energía bien determinados y cuando el átomo absorbía energía el electrón saltaba a otro nivel más alejado del núcleo, pasando a un estado excitado, pero como este estado no es un estado estacionario, o de mínima energía, el electrón eventualmente regresaba a su órbita anterior de menor energía, y al hacerlo emitía la energía sobrante en forma de un cuanto de energía o fotón de una frecuencia particular. Esta emisión de radiación se manifiesta por medio de una línea característica, cuya frecuencia era proporcional a la diferencia de energía entre los niveles involucrados en la transición atómica. En la figura de la derecha se muestra una transición del electrón del segundo nivel al primer nivel (estado fundamental) y la emisión de un fotón de energía E=hf, donde h es la constante de Planck y f la frecuencia de la radiación emitida.
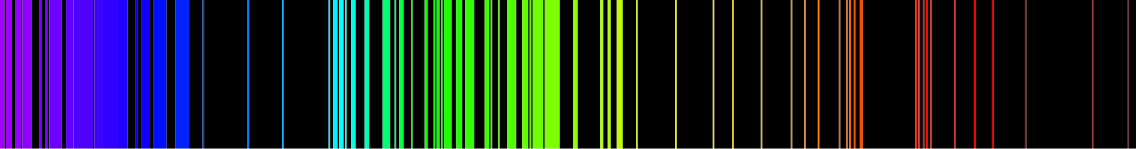
Estas líneas habían sido observadas, ya desde mediados del siglo XIX, en los espectros de la radiación electromagnética emitida por los átomos de elementos gaseosos, cuando eran excitados mediante una descarga eléctrica. Se conocía que esos espectros eran discontinuos y mostraban líneas paralelas, que correspondían a unas pocas longitudes de onda, que eran características del elemento que emitía la luz. En forma similar si el mismo elemento, en estado gaseoso, recibia radiación electromagnética, solo absorbía de la radiación algunas determinadas frecuencias, precisamente las mismas frecuencias en las que emitía, dando lugar a un espectro de absorción. En la figura se observa el espectro de emisión del Hierro (fuente wikipedia).
Si bien existían fórmulas empíricas para hallar las frecuencias de dichas lineas, su origen no se conocía. Y la física clásica no podia dar una explicación del fenómeno.
La hipótesis de Bohr, si bien padecía de algunas imprecisiones, permitió dar un gran paso adelante al compatibilizar la teoría con el experimento.
Por este aporte Bohr recibió el Premio Nobel en Física en 1922.
Otras de sus importantes contribuciones fueron la descripción del núcleo por medio de la teoría de la gota líquida y la teoría de la complementaridad, sobre el comportamiento dual de la materia como onda o como partícula, pudiendo percibirse un aspecto a la vez y no ambos simultáneamente.
Debug data: