Diferencia entre revisiones de «Niels Bohr»
m |
|||
| Línea 6: | Línea 6: | ||
problemas. [[Imagen:bohr2.jpg|framed|left|180px]] De acuerdo con la teoría clásica, toda partícula cargada que es acelerada emite energía, por lo tanto los electrones atómicos al moverse alrededor del núcleo deberían |
problemas. [[Imagen:bohr2.jpg|framed|left|180px]] De acuerdo con la teoría clásica, toda partícula cargada que es acelerada emite energía, por lo tanto los electrones atómicos al moverse alrededor del núcleo deberían |
||
perder energía y caer en espiral hacia el núcleo haciendo colapsar el átomo. |
perder energía y caer en espiral hacia el núcleo haciendo colapsar el átomo. |
||
| − | Para resolver este dilema Bohr |
+ | Para resolver este dilema en 1013 Bohr combinó este modelo atómico con la idea de "cuanto |
| − | de energía" postulada en 1901 por Planck |
+ | de energía" postulada en 1901 por Planck para formular los postulados de cuantización del momento angular del electrón, y de la energía del electrón en su órbita estable. Según este postulado los electrones en una órbita estable |
| + | no emitían radiación. De esta forma los electrones existen en niveles de energía bien determinados y cuando el átomo absorbe energía el electrón salta a otro nivel más alejado del núcleo, pero este nivel no corresponde al estado estacionario o de mínima energía, de forma tal que el electrón eventualmente regresa a su órbita anterior de menor energía emitiendo la energía sobrante en forma |
||
| − | de radiación. |
||
| + | de radiación. Esta emisión de radiación se manifiesta por medio de una línea característica, cuya longitud de onda corresponde a la diferencia de energía entre los niveles involucrados en la transición atómica. |
||
| + | Estas líneas habian sido observadas en el espectro de la radiación electromagnética de los átomos de un elemento gaseoso cuando eran excitados mediante |
||
| + | una descarga eléctrica. Se conocia que esos espectros eran discontinuos mostrando lineas paralelas, que correspondían |
||
| + | a unas pocas longitudes de onda, que eran características del elemento que emitía la luz. Si bien existían fórmulas empíricas para hallar las frecuencias de dichas lineas, su origen no se conocía. |
||
| + | Y la física clásica no podia dar una explicación del fenómeno. |
||
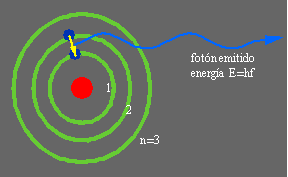
[[Imagen:bohratf.png|framed|right|170px]] Esta hipótesis, si bien padecía de algunas imprecisiones, permitió dar un |
[[Imagen:bohratf.png|framed|right|170px]] Esta hipótesis, si bien padecía de algunas imprecisiones, permitió dar un |
||
gran paso adelante al compatibilizar la teoría con el experimento. |
gran paso adelante al compatibilizar la teoría con el experimento. |
||
Revisión del 01:08 26 mar 2025
[1885-1962] Nació en Copenhague, Dinamarca, donde se educó y pasó la mayor parte de su vida. Después de doctorarse en 1911 viajó a Inglaterra para trabajar con J.J. Thomson, quien había descubierto el electrón 15 años antes. Comenzó a trabajar en estructura atómica siguiendo el modelo atómico sugerido por Rutherford, el cual presentaba algunos
problemas.
De acuerdo con la teoría clásica, toda partícula cargada que es acelerada emite energía, por lo tanto los electrones atómicos al moverse alrededor del núcleo deberían
perder energía y caer en espiral hacia el núcleo haciendo colapsar el átomo. Para resolver este dilema en 1013 Bohr combinó este modelo atómico con la idea de "cuanto de energía" postulada en 1901 por Planck para formular los postulados de cuantización del momento angular del electrón, y de la energía del electrón en su órbita estable. Según este postulado los electrones en una órbita estable no emitían radiación. De esta forma los electrones existen en niveles de energía bien determinados y cuando el átomo absorbe energía el electrón salta a otro nivel más alejado del núcleo, pero este nivel no corresponde al estado estacionario o de mínima energía, de forma tal que el electrón eventualmente regresa a su órbita anterior de menor energía emitiendo la energía sobrante en forma de radiación. Esta emisión de radiación se manifiesta por medio de una línea característica, cuya longitud de onda corresponde a la diferencia de energía entre los niveles involucrados en la transición atómica. Estas líneas habian sido observadas en el espectro de la radiación electromagnética de los átomos de un elemento gaseoso cuando eran excitados mediante una descarga eléctrica. Se conocia que esos espectros eran discontinuos mostrando lineas paralelas, que correspondían a unas pocas longitudes de onda, que eran características del elemento que emitía la luz. Si bien existían fórmulas empíricas para hallar las frecuencias de dichas lineas, su origen no se conocía. Y la física clásica no podia dar una explicación del fenómeno.
Esta hipótesis, si bien padecía de algunas imprecisiones, permitió dar un
gran paso adelante al compatibilizar la teoría con el experimento. Por este aporte Bohr recibió el Premio Nobel en Física en 1922. Otras de sus importantes contribuciones fueron la descripción del núcleo por medio de la teoría de la gota líquida y la teoría de la complementaridad, sobre el comportamiento dual de la materia como onda o como partícula, pudiendo percibirse un aspecto a la vez y no ambos simultáneamente.
Debug data: